Diferența dintre alcalinitate și elementaritate
 Share
Share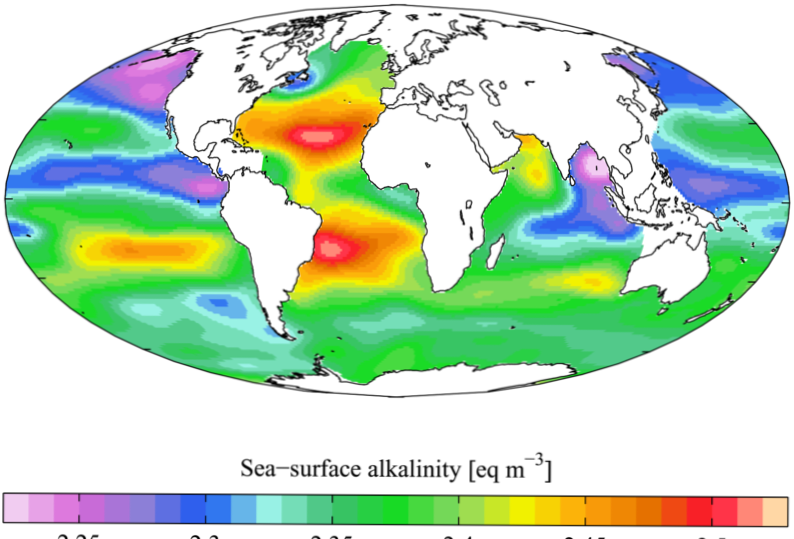
Diferența cheie - alcalinitatea vs. elementaritatea
Cei doi termeni de "alcalinitate" și "bazicitate" sunt destul de confuze. Majoritatea oamenilor știu că există o diferență între acești doi parametri, dar numai câțiva dintre ei pot să o definească corect. diferența cheie între cei doi termeni este cel mai bine explicat în definițiile lor. Basicitatea este o măsură care depinde direct de scala pH-ului și alcalinitatea este cantitatea de acid necesară pentru scăderea pH-ului într-o valoare semnificativă a acidului; este, de asemenea, cunoscut sub numele de tamponarea capacității unui corp de apă. Cu alte cuvinte, valoarea pH-ului soluțiilor de bază variază de la 7 la 14; unde soluțiile cu valori ridicate ale pH-ului sunt mai elementare. Ambele au mai multe definiții, însă ideea generală este similară.
Ce este alcalinitatea?
Alcalinitatea este unul dintre cei mai importanți parametri în corpurile acvatice și este foarte esențial pentru organismele acvatice. Alcalinitatea măsoară capacitatea corpurilor de apă de a neutraliza acizi și baze. Cu alte cuvinte, capacitatea de tamponare a unui corp de apă menține pH-ul la o valoare relativ stabilă. Apa conținând bicarbonați (HCO3-), carbonați (CO32-) și hidroxizii (OH-) este un tampon bun; se pot combina cu H+ ioni în apă pentru a crește pH-ul (devine mai bazic) a apei. Atunci când alcalinitatea este prea mică (capacitatea de tamponare este scăzută), orice acid adăugat în corpul de apă își reduce pH-ul la o valoare acidă mai mare.
 Ce este Basicitatea?
Ce este Basicitatea?
De bază este o proprietate a bazelor, măsurată în scară pH. Bazele sunt compușii care conțin pH peste 7; de la pH = 8 (mai puțin bazic) până la pH = 18 (mai bazică). Fundamentarea unui compus poate fi definită în trei moduri diferite. Potrivit teoriei lui Arrhenius, bazele sunt substanțele care se disociază în mediu apos care produce OH- ioni. În teoria lui Bronsted-Lowry, acceptorii de protoni se numesc baze. Conform teoriei lui Lewis, un donator de electroni este numit bază. Basicitatea este ionizarea forței pentru a produce OH- ioni, abilitatea de a accepta protoni sau capacitatea de a dona electroni.

Teoria lui Thomas Martine Lowry - Bronsted-Lowry
Care este diferența dintre Alcalinitate și Basicitate?
Definiția alcalinității și bazicității:
Alcalinitate: Există mai multe definiții.
Alcalinitatea este capacitatea de neutralizare a substanțelor dizolvate într-o probă de apă măsurată în miliechivalenți pe litru.
Suma speciilor chimice carbonatabile și noncarbonate titrabile într-o probă de apă filtrată.
Capacitatea apei de a neutraliza o soluție acidă.
Capacitatea de tamponare a apei pentru menținerea unui pH relativ stabil, fără a modifica valoarea pH-ului, când se adaugă acid.
Bazicitatea: Trei teorii sunt folosite pentru a defini aciditatea și bazicitatea.
Arrenhius: Bazele sunt speciile care ionizează pentru a produce OH- in apa. Baza crește deoarece ele ionizează mai mult, dând OH- in apa.
Bronsted-Lowry: Proton (H+) acceptori se numesc baze.
Lewis: Donoarele cu donori de electroni se numesc baze.
Factorii care afectează alcalinitatea și fundamentalitatea:
Alcalinitate: Alcalinitatea nu depinde de valoarea pH-ului; corpurile de apă pot avea valoare pH mai mică (foarte acidă) sau mai mare (bazică) cu o valoare mai mare pentru alcalinitate. Alcalinitatea este determinată de mai mulți factori, cum ar fi roci, sol, săruri și anumite activități industriale (apa uzată care conține săpun și detergenți este alcalină) de către om. De exemplu, zonele în care calcarul (CaCO3) este disponibil în mod semnificativ poate avea mai multă apă alcalină.
Bazicitatea: Factorii care afectează bazicitatea unui compus variază în funcție de definiția bazicității. De exemplu, disponibilitatea unei perechi de electroni a unei baze depinde de trei factori.
electronegativitate: CH3-> NH2-> HO-> F-
Când privim atomii din același rând în tabelul periodic, cel mai electronegativ atom are bazicitatea mai mare.
mărimea: F-> Cl-> Br-> I-
Atunci când se analizează un rând al tabelului periodic, cu cât atomul este mai mare, densitatea electronului este mai mică și este mai puțin de bază.
Rezonanţă: RO-> RCO2-
Moleculele care au mai multe structuri de rezonanță sunt mai puțin fundamentale, din moment ce este mai puțin disponibilă electronul decât o încărcare negativă localizată.
Datorită fotografiei:
1. „WOA05 GLODAP pd ALK AYool"De Plumbago - Muncă proprie. [CC BY-SA 3.0] prin intermediul Commons
2. „Thomas Martin Lowry2"De Anonim - Obituary de către Faraday Soc. (1936). [Public Domain] prin intermediul Commons
