Cum se calculează ordinul obligațiunilor și lungimea obligațiunilor
 Share
Share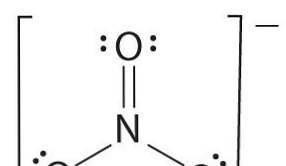
Determinarea anumitor parametri, cum ar fi dimensiunea, lungimea și unghiul în scară atomică, nu este ușor. Datorită importanței acestor parametri, oamenii de știință au dezvoltat metode pentru a deduce sau a calcula parametrii la nivel atomic. Ordinea ordonării și lungimea legăturii sunt doi parametri importanți care indică tipul și forța legăturilor dintre o pereche de atomi.
Acest articol explică,
1. Ce sunt ordinul obligațiunilor și lungimea obligațiunilor
2. Cum se calculează ordinul obligațiunilor și lungimea obligațiunilor
- Cum să calculați ordinul obligațiunilor
- Cum se calculează lungimea obligațiunilor
Ce sunt Ordinea obligațiunilor și Lungimea obligațiunilor
Lungimea legăturii și ordinea obligațiunilor sunt doi parametri care sunt asociați cu legături covalente. Ordinea ordinelor este numărul de legături chimice dintre doi atomi și lungimea legăturii este distanța dintre două nuclee de atomi care sunt legate covalent împreună.Acest articol explică cum se calculează ordinea obligațiunilor și lungimea obligațiunilor la nivel atomic.
Cum să calculați ordinul obligațiunilor
Ordinea ordinelor este numărul de legături chimice dintre doi atomi. Aceasta indică stabilitatea unei legături. În legături covalente, ordinea obligațiunilor este numărul de electroni partajați. De exemplu, ordinea de legare a unei perechi de atomi legată printr-o singură legătură este una, în timp ce ordinea de legătură a unei perechi de atomi legată printr-o dublă legătură este de două. Ordinea zero a obligațiunilor indică faptul că nu există nici o legătură între atomi. Stabilitatea unei molecule crește odată cu creșterea ordinii de obligațiuni. Moleculele cu legătura de rezonanță nu trebuie să fie un număr întreg. În compușii covalenți cu doi atomi, ordinea legăturii dintre o pereche de atomi este determinată mai întâi prin tragerea structurii Lewis și apoi determinarea tipului de legături dintre legătura atomică - zero, legătura unică, dublă sau triplă. De exemplu, ordinea obligatorie a gazului hidrogen este determinată după cum urmează.
- Desenați structura lui Lewis
H: H
- Determinați numărul de legături / pereche de electroni de valență
O pereche de electroni, deci ordinul de obligațiuni este 1.
Dacă există mai mult de doi atomi, ordinea obligațiunilor este determinată după cum urmează. Vedeți exemplul: ion nitrat.
- Desenați structura lui Lewis

- Numără numărul total de obligațiuni (în funcție de ionul de azotat, de 4)
- Numărul de grupe de legături între atomii individuali (conform amoniacului, al 3-lea)
- Prin urmare, ordinea obligațiunilor = numărul total de obligațiuni / numărul de grupuri de obligațiuni
= 4/3
= 1,33
Prin urmare, ordinea de legare a ionului nitrat este de 1,33
Cum se calculează lungimea obligațiunilor
Lungimea legăturii este distanța dintre două nuclee de atomi care sunt legate covalent împreună. Lungimea legăturii este de obicei în intervalul de la 0,1 la 0,2 nm. Când doi atomi similari sunt legați împreună, jumătate din lungimea legăturii este menționată ca raza covalentă. Lungimea legăturii depinde de numărul de electroni legați de doi atomi sau de ordinea obligațiunilor. Mai mare ordinea obligațiunilor, scurtarea lungimii legăturii se va datora forțelor puternice de tragere a nucleelor încărcate pozitiv. Unitatea de lungime a legăturii este picometer. În legăturile unice, duble și triple, lungimea legăturii crește în ordinea lui
legătura triplă Electronegativitatea poate fi utilizată pentru a calcula lungimea legăturii dintre doi atomi având diferite electronegativități. Următoarea formulă empirică a fost propusă de Shoemaker și Stevenson pentru a calcula lungimea legăturii. dA-B = rA + rB - 0,09 (xA - XB) dA-B este distanța de legătură între doi atomi A și B, rA și rB sunt raze covalente ale lui A și B și (XA - XB) este diferența de electronegativitate între A și B. O altă metodă este folosită pentru a calcula lungimea aproximativă a legăturii. În această metodă, prima structură Lewis este trasată pentru a determina tipul de legătură covalentă. Apoi, folosind o diagramă * făcută pe studiile realizate de Cordero și colab., și Pyykkö și Atsumi, raza corespunzătoare a legăturilor realizate de fiecare atom este determinată. Apoi, lungimea legăturii este determinată prin luarea sumei celor două raze. De exemplu, atunci când se determină lungimea de legătură a dioxidului de carbon, este trasată prima structură Lewis. Conform diagramei, raza covalentă a legăturii duble cu carbon este de 67 picometre, iar cea a legăturii duble cu oxigen este de 57 picometre. Prin urmare, lungimea de legătură a dioxidului de carbon este de aproximativ 124 picometre (57 pm + 67 pm). * Diagrama covalentă se găsește aici Referinţă: Cordero, Beatriz și colab. "Radiurile covalente revizuite". Dalton Transactions 21 (2008): 2832-2838. Libretexts. "Ordine și lungimi de obligațiuni." LibreTexts. Libretexts, 05 decembrie 2016. Web. 10 ianuarie 2017. Lister, Ted și Janet Renshaw. Înțelegerea chimiei pentru nivel avansat. Np: Nelson Thornes, 2000. Print. Pratiyogita Darpan. "Proprietățile elementelor în relație cu structura lor electronică". Concurență Science Vision Aug. 1998: n. pag. Imprimare. Pyykkö, Pekka și Michiko Atsumi. "Radii moleculare dublu-obligatorii moleculare pentru elementele Li-E112." Chimie-Un European Journal 15.46 (2009): 12770-12779.
